| Статистика |

Онлайн всего: 3 Гостей: 3 Пользователей: 0 |
|
Молекулы
Национальный исследовательский ядерный
университет

Факультет: «Автоматики и электроники»
Кафедра: «Микро- и наноэлектроники»

Конспект
по дисциплине «Компьютерный практикум-14»
«МОЛЕКУЛЫ»
Выполнил: студент группы А04-09 Ямщиков В.М.
Проверил: доцент Лапшинский В.А.
Дата: 30 июня 2014 г.
Москва 2014
«Молекулы»
E-mail: Vitas-life@rambler.ru
ОГЛАВЛЕНИЕ
Аннотация...............................................................................4
Глоссарий................................................................................5
Введение................................................................................6
Глава 1. Строение вещества....................................................7
1.1 Тепловое движение........................................................9
1.2 Поверхностные силы......................................................10
Глава 2. Температура.............................................................11
2.1 Термометры.................................................................11
2.2 Теория идеального газа...............................................12
Глава3. Состояние вещества..................................................15
3.1 Кипение....................................................................15
3.2 Плавление.................................................................18
3.3 Влияние давления на температуру плавления.............18
Интересные факты.................................................................19
Заключение..........................................................................22
Литература............................................................................23
АННОТАЦИЯ
Данная работа посвящена книге[1], написанной физиком, лауреатом нобелевской премии, академиком АН СССР Л.Д. Ландау и физиком-кристаллографом, доктором физико-математических наук А.И. Китайгородский.
Книга, как понятно из названия, посвящена молекулам, а точнее тому факту, что весь окружающий нас мир состоит из молекул, и, что многие физические явления можно описать, используя атомную теорию строения тел.
Представление о молекулярном строении тел родилось у греков еще 25 веков тому назад, и понятно, что накопленных знаний очень много, поэтому в конспекте мы обговорим только некото-рые и, возможно, самые важные явления, которые описывает атомная теория.
Ключевые слова: молекула, атомы, вещество, температура, давление, объём, молекулярная физика.
ГЛОССАРИЙ
Вещество - вид материи, обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество). В некоторых условиях, как например, в нейтронных звездах, могут существовать достаточно необычные виды вещества.
Плавление - это процесс перехода тела из кристаллического
твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Температура - скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
ВВЕДЕНИЕ
Атомы очень и очень малы, поэтому их невозможно увидеть невооруженным глазом. Например, радиус ядра водорода составляет всего лишь 5.3*10^(-9) см. Из-за этого долгое время ученые не знали, как атомы выглядят, какое имеют строения. Естественно было придумано тысячи теорий, которые описывали строения атома, но нужна была только одна, наиболее точная. И такой выдающийся ученый, как Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие солнечной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Эта теория оказалась незавершенной, так как противоречила некоторым правилам электродинамики, но Нильс Бор со своими посту-латами смог это исправить.
Несмотря на то, что атом очень мал, все же были придуманы методы и установки, с помощью которых можно было наглядно увидеть атомные решетки. Одно из таких устройств называется ионный микроскоп. В нем есть стеклянный сферический корпус, из которого выкачен весь воздух и закачено небольшое количество гелия (для улучшения видимости картины), и в центр помещена тонкая металлическая игла. Создается высокая разность потенциалов (между иглой и сферой), происходит интересный физический процесс между иглой атомами гелия, и мы наблюдаем картинку строения решетки материала, из которой сделана игла.
Интересный факт: масса атома составляет порядка
Ma=1.66043*10^ (-24) г
Но с другой стороны, всего лишь в одном грамме содержится
Na=6.02209*10^ (23) атомов
Пугающе большое число, правда?
ГЛАВА 1. СТРОЕНИЕ ВЕЩЕСТВА
Молекулы состоят из атомов, причем количество атомов входящих в молекулу может быть каким угодно, от двух или трех до десятков тысяч и даже сотни тысяч (как в молекуле белка). Причем молекула - это не просто куча «кирпичей», а сложная архитектурная постройка, где каждый атом занимает свое определенное место, и его соседи занимают определенные места.
Давайте разберем взаимодействие атомов друг с другом. На рисунке 1 изображена кривая потенциальной энергии двухатом-ной молекулы.

Рисунок 1. Зависимость энергии
взаимодействия от расстояния.
Эта кривая хорошо описывает взаимодействие между атомами. Модно заметить, что на этой кривой есть яма (энергетический минимум), в ней атом находится в положении равновесия, лишь слегка колеблется около него. Слева от ямы кривая начинает резко возрастать, два атомы становятся ближе и ближе друг к другу, и как видно, сила, расталкивающая их, становится очень и очень большой (так как сила есть градиент от потенциальной энергии). Справа от ямы кривая плавно стремится к 0. На этих расстояниях атомы ощущают силу, которая стремится сблизить их.
1.1 ТЕПЛОВОЕ ДВИЖЕНИЕ
Атомы взаимно притягиваются (это следует из того, что существуют твердые тела). Так же они отталкиваются (иначе бы они с легкостью притягивались до очень высокой плотности). И как уже известно существует три основных состояния вещества: твердое, жидкое и газообразное. Все они отличаются тепловым движением.
В твердых телах движение молекул практически отсутствует, атомы лишь колеблются вокруг своих положений равновесий. Но если, например, сообщить твердому телу энергию, то колебания начнут нарастать и дойдут до такой степени, что ре-шетка разрушится, и атомы относительно друг друга станут намного подвижней. В этом момент твердое состояние вещества переходит в жидкое состояние. Если продолжить подавать энергию, то молекулы начнут покидать поверхность жидкого тела и начнут двигаться с еще большей скоростью в различных направлениях. Они станут находиться на больших, по сравнению с собственным размером, расстояниях от своих сородичей. Такое состояние называется газ (от греческого «хаос»).
1.2 ПОВЕРХНОСТНЫЕ СИЛЫ
Очень интересное явление в физике связано с поверхностными силами воды[1]. Можно просто перечислить малую долю явлений, которые возникают за счет поверхностного натяже-ния. Например, если намазать палец парафином и опустить в воду, а затем вынуть, то и палец, и парафин останутся сухими. В этом случае вводятся понятия полного и неполного смачивания.
Если, например, каплю воды положить на стекло, то она растечется, а если на парафин - примет форму шарика. Еще один любопытный пример полного и неполного смачивания заключается в том, что если положить смоченную в масле иголку на поверхность воды, она не утонет.
Также интересны явления, возникающие в очень тонких трубках, показанные на рисунке 2. Они называются капиллярными явлениями[2].

Рисунок 2. Явление капиллярности.
Описать такие явления можно с помощью молекулярной теории. Например, на границе вода-воздух, вода с одной сторо-ны сильней притягивается, так как там количество притягиваю-щих ее молекул больше, а с другой стороны, где находится воз-дух, молекул по сравнению с водой очень мало, поэтому силы направлены во внутрь жидкости, из-за чего жидкость и стремится минимизировать свою площадь.
ГЛАВА 2. ТЕМПЕРАТУРА
2.1 ТЕРМОМЕТРЫ
Температура - это одна из важных макроскопических характеристик вещества. Температуру измеряют термометрами. В ос-нову устройства термометров положено использование различ-ных свойств тел, чувствительных к температуре. Чаще всего пользуются свойством: при нагревании тело способно изменять свой объем, т.е. если тело расширяется, значит, оно было нагрето, и наоборот.
Конечно, приборы, которые построены на таком принципе, не могут похвастаться высокой точностью измерения, но сейчас существует уже множество электронных термометров, которые могут измерять температуру с точностью до тысячного знака после запятой.
Существуют различные единицы измерения температуры. Приведем основные: Цельсий, Кельвин, Фаренгейт[1]. Градус Цельсия равен одному кельвину K, а ноль шкалы Цельсия уста-новлен таким образом, что температура тройной точки воды равна 0°C. В итоге, шкалы Цельсия и Кельвина сдвинуты на 273. А вот единица Фаренгейта не равна единице Цельсия, и вычисляется по формуле:
С = 5/9 х ( F - 32)
2.2 ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА
Теория идеального газа - одна из важных теорий физики, которая описывает поведение частиц при некоторых условиях. Такие условия называются нормальными, а газ при этих условиях называется идеальным.
Далее представлены основные положения теории идеального газа:
1. Считается что газ – это совокупность маленьких шариков, не имеющих объема.
2. Молекулы газа друг с другом не взаимодействуют. При таком условии можно описать поведение газа, пользуясь только законами Ньютона. Несмотря на такие грубые упрощения, теория идеального газа хорошо описывает многие явления, и уравнение состояния идеального газа оказывается намного проще, чем можно было бы представить:
PV = m/μ RT
где p - давление, Па;
V-объем, м3;
m - масса, г;
М - относительная молярная масса, г/моль;
R-универсальная газовая постоянная,
T-температура, К;
Также эта теория называется молекулярно-кинетической, потому что давление такого газа прямо пропорционально сред-ней кинетической энергии молекул. Но что самое главное, ока-зывается, что скорость молекул зависит от их температуры.
Температура тела это средняя температура всех молекул, т.е каждая молекула нагрета по-разному и движется каждая с раз-ной скоростью[1], поэтому мы используем обычно среднюю ве-личину (температуры, скорости, энергии, давления, объема). На рисунке 3 представлено как именно распределяются частицы по скоростям.
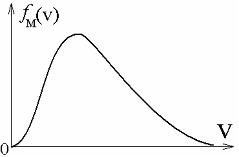
Рисунок 3. Функция распределения частиц по скоростям.
ГЛАВА 3. СОСТОЯНИЯ ВЕЩЕСТВА
3.1 КИПЕНИЕ
Если опустить термометр в воду, налитую в чайник, включить нагреватель и смотреть, как изменяется показатель термо-метра, то мы увидим, как плавно температура поднимается до ста градусов. Потом, после достижения ста градусов, темпера-тура перестает расти и поддерживается постоянной, хотя тепло до сих пор подается. Как такое может быть? На этот вопрос лег-ко ответить, взглянув на рисунок 4, откуда видно, что вода образуется в пар, а на это требуется немалое количество энергии.

Рисунок 4. Зависимость температуры воды от времени нагре-вания. На рисунке участок AB – нагревание льда; BC - плавление льда; CD - нагревание воды; DE - испарение воды; EF - нагревание пара.
Оказывается, что температура кипения зависит от давления. График этой зависимости показан на рисунке 5.
Например, на одной из вершин Эльбруса вода начинает заки-пать уже при 82 С0. Таким образом, у нас появляется возможность получить «кипяток» имеющий температуру замерзающей воды.
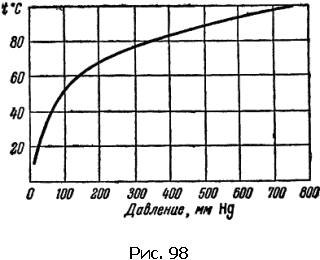
Рисунок 5.Зависимость температуры кипения воды от давления.
Кипение - это быстрый процесс, и от кипящей воды за короткий срок не остается и следа. Но есть и другое явление пре-вращения воды в пар - это испарение, но этот процесс, в отличие от кипения, очень долгий, например, из обычного граненого стакана 400мл на открытом воздухе при постоянной температуре 27 С0 и постоянной влажности воздуха, вода испарится за 7 дней.
3.2 ПОЛУЧЕНИЕ НИЗКИХ ТЕМПЕРАТУР
Существенного уменьшения температур можно достичь различными способами. Но идея всех этих способов ода и та же: необходимо заставить тело затратить свою внутреннюю энергию. Как же это сделать? Вот некоторые способы:
1. Заставить жидкость кипеть, понижая давление. Например, из сосуда с жидкостью выкачивать воздух.
2. Каскадный, т.е сжижение газов производится ступенями: последовательно в жидкость превращают этилен, кислород, азот, водород - вещества с температурой кипения:
-103 С0, -183 С0, -196 С0, - 253 С0 соответственно.
3. В технических установках газ заставляют быстро расширяться и производить работу за счет внутренней энергии (адиабатный процесс).
Однако существуют и другие методы получения настолько низких температур, которые превышают абсолютный ноль всего на несколько тысячных долей градуса.
3.3 ПЛАВЛЕНИЕ
Нет такого твердого тела, которое бы сколь угодно долго противостояло бы повышению температуры. Рано или поздно твердый кусочек превращается в жидкость (мы уже разбирали процесс плавления).
Самой высокой температурой плавления обладает воль-фрам: 3380 С0. Золото плавится при 1063 С0, железо – при 1539 С0. Но есть и легкоплавкие металлы. Ртуть, например, плавится при -39 С0. Органические вещества не имеют высоких темпера-тур плавления. Нафталин плавится при 80 С0, толуол при – 94,5 С0.
Примечание: график плавления представлен на странице 14, рисунок 4, участок BC.
3.4 ВЛИЯНИЕ ДАВЛЕНИЯ НА
ТЕМПЕРАТУРУ ПЛАВЛЕНИЯ
Как в случае с испарением жидкости, так и в случае с твердым телом давление влияет на температуру плавления. Чем больше давление, тем меньше температура плавления (однако, есть несколько исключений).
Но стоит отметить, что влияние давления на температуру плавления много меньше аналогичного эффекта для кипения.
Есть интересный пример физического явления, подходящего к этой теме. Почему коньки скользят только по льду, но не по столь же гладкому паркету? Потому что между острием конька и льдом образуется вода. Тупые коньки скользят плохо, потому что площадь опоры больше и давление меньше. При заточенном коньке создается давление в десятки тысяч атмосфер и лед все-таки плавится.
ИНТЕРЕСНЫЕ ФАКТЫ
1. Помимо таких фазовых преобразований как кристаллизация, плавление, испарение, конденсация, есть еще сублимация и возгонка - процесс, в ходе которого твердое состояние вещества сразу переходит в пар, без прохождения промежуточного состояния - состояния жидкости[2].
2. Нам известно, что любое тело, которое мы будем охлаждать, при какой-то определенной температуре станет твердым телом. Но существует химический элемент «урод» - это гелий. Даже при абсолютном нуле он не становится твердым.
3. В фазовых переходах существует так называемая тройная точка - это момент, когда вещество находится сразу в трех состояниях (в жидком в твердом и газообразном). Например, лед в сосуде, который плавится, и вода испаряется.
4. Вода может идти против сил притяжения, по узким трубам в процессе, который называется капиллярное явление.
5. Любопытно, но стекло не является твердым телом. В действительности стекло - это жидкость, но оно настолько вязкое, что мы не можем увидеть, как оно течет. Поэтому внизу старых окон часто можно заметить утолщения.
6. Мы уже говорили о том, что тела при нагревании расширяются, и каждое тело по-разному расширяются в зависимости от температуры. Поэтому если невозможно открыть металлическую крышку в стеклянной бутылке, то просто нужно подставить эту бутылку под горячую воду. И так как металл расширяется не так сильно как стекло, мы сможем открыть крышку.
7. У бензина не существует какой-то конкретной точки замерзания. Таким образом, он может замерзнуть при любой температуре в диапазоне от -118 С0 до -151 С0. При этом, замерзая, бензин не превращается в твердое тело, он напоминает, скорее, воск или резину.
8. Скорость света способна меняться в зависимости от материала, по которому распространяется свет. Ученые смогли в лабораторных условиях замедлить движение частиц света до 17 м/с. Для этого они пропускали фото-ны через слиток рубидия, охлажденного до близкой к абсолютному нулю температуры ( -273 С0).
9. Молекулярная плотность воды в жидкой форме больше, чем в твердой. Поэтому лед плавает в воде.
ЗАКЛЮЧЕНИЕ
В молекулярной физике остается еще много интересных физических явлений, которые не смогли объяснить многие теоретики со всего мира. Поэтому эта область науки до сих пор подлежит изучению. Но, несмотря на это, молекулярная физика принесла огромный вклад в развитии техники и технологий.
И в доказательство всей важности этой науки можно привести слова великого американского физика - теоретика Ричарда Фейнмана: «Если бы меня отправили в прошлое и вместе с этим стерли всю память, но дали предложение выбрать какую из теорий я смогу взять с собой, то конечно мой выбор будет за молекулярной физикой, ведь какой это большой шаг для человечества знать, что все вокруг состоит из атома».
ЛИТЕРАТУРА
1. Ландау Л.Д., Китайгородский А.И.. Физика для всех: Молекулы. – 5-е изд.,испр. – М.: Наука. Главная редакция физико – математической литературы, 1982. – 208 с.
2. Фейнман Р., Лейтон Р., Сэндс М.. Фейнмановские лекции по физике: в 9 ч. Ч. 4: Кинетика, теплота, звук / Р. Фейнман. – М.: Мир, 1967. - 203 с.: ил. |
| Категория: Конспекты (курсы КП и ПК) | Добавил: vitas-life (03.07.2014)
| Автор: Ямщиков Виталий
|
| Просмотров: 1216
| Рейтинг: 0.0/0 |
Добавлять комментарии могут только зарегистрированные пользователи. [ Регистрация | Вход ] |
|